
18225607483
客服服务热线
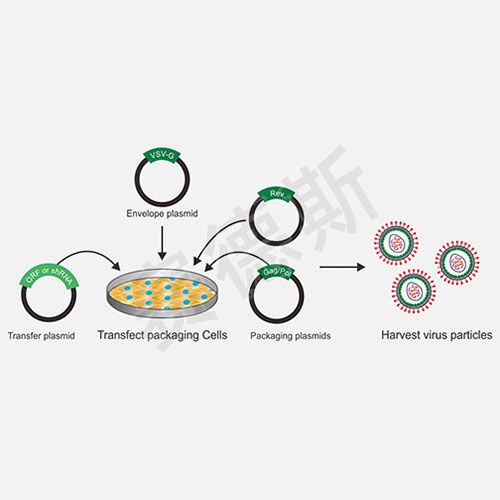

1、稳转株构建流程
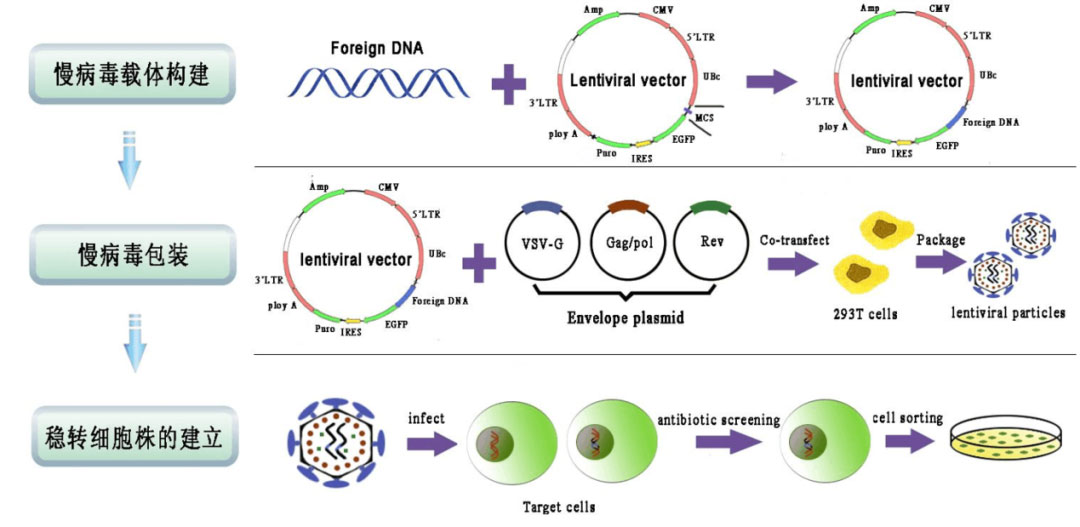
稳转株即稳定表达细胞株,指的是基于某一细胞系构建的持续过表达或干扰某特定基因的细胞系。用转染质粒或病毒侵染的方法将构建好的含靶基因的载体导入细胞,根据不同的基因载体中所含的抗性标志选用相应的药物进行筛选混合阳性克隆。针对瞬时转染,外源基因在短时间转录翻译得到的蛋白量很少,能够满足小量蛋白的制备,大量生产成本很高。慢病毒感染-药物筛选法是目前广泛运用的稳转株构建方法,具有高效整合,目标细胞广泛等特点。最常用的真核表达载体抗性筛选标志物有新霉素(neomycin),潮霉素(hygromycin)和嘌呤霉素(puromycin)。常用G418来代替新霉素进行选择性筛选,筛选得到可稳定表达目的蛋白,或者稳定表达沉默特定基因的细胞株。
2、准备及预实验
【1】确定目标细胞系的相关信息
(1)包括细胞的培养条件,细胞的增值速度,支原体污染情况。
【2】预实验确定MOI值
(2)查阅文献确定慢病毒在目标细胞系中的MOI值
(3)参考查阅得到的数据,设计梯度实验,摸索最适MOI
【3】预实验确定筛选药物用量
(1)查阅puro/G418/潮霉素等在目标细胞系中稳转株筛选的致死用量信息
(2)参考查阅得到的数据,确定3个药物浓度梯度(如没有相关信息,则需将药物浓度梯度范围增大数量增多至6个)
(3)第一天将细胞铺于6孔板中,使细胞到第二天的密度约90%
(4)第二天按设置的药物浓度加入药物
(5)第四天换液,并重新加入药物
(6)第七天观察,找到细胞致死率100%时药物浓度最低的孔,该孔使用的药物浓度为药物筛选浓度
3、脂质体转染筛选稳转株
【1】将复苏后常规的细胞按照1-3×10^5接种到6孔板中,加入2-4ml的完全培养基,混合放置在二氧化碳培养箱中37℃过夜。
【2】第二天进行转染,在无菌条件下配置如下溶液:a 用250ml的无血清培养基稀释4ug的待转染的质粒。b 用250ul的无血清培养基稀释6ul的lipo转染试剂。各自孵育5min(血清的存在会影响转染效率,因此要使用无血清培养基转染)
【3】将ab溶液混合,室温下孵育20min。
【4】在进行(2)(3)之前或过程中,细胞培养至80%单层左右,用PBS洗涤细胞一至两次,每孔加入1.5ml的无血培养基,并将混合后的ab溶液逐滴加入到每孔中,按十字方向轻摇混匀,二氧化碳培养箱中培养4-6h。
【5】将转染液倒出,换为完全培养基继续培养。
【6】48h后加入选择性抗生素进行稳转株筛选,预实验确定抗生素的杀伤浓度。
4、病毒感染筛选稳转株
【1】细胞铺板:将细胞接种于6孔板中,使细胞在第二天的密度达到约70%左右
【2】病毒感染:根据预实验确定的MOI值,计算需要加入的慢病毒体积
【3】换液:根据实际情况进行换液,对于一些耐受弱的细胞,就要及时进行换液;一些耐受强的细胞,则可以感染48-72h再进行换液
【4】观察感染效率:感染后72h,观察感染效率,效率最低不应低于40%
【5】 筛选
(1)嘌呤霉素筛选:嘌呤霉素最佳的作用时间是3-10天之间,嘌呤霉素常用浓度范围在1-10μg/ml。
通过预实验确定了最佳筛选浓度后,就可以做病毒感染了。
a.感染: 感染培养72h(感染时间根据细胞的具体情况及感染效率而定)后在6孔板中加入之前预实验确定的药物浓度
b.加puro:在6孔板中加入之前预实验确定的puro药物浓度
c.换液:根据培养基的颜色和细胞生长情况,每3~5天更换一次筛选培养基。当有大量细胞死亡时,可以把puro浓度减半维持筛选
d.观察:每天观察细胞的状态,生长情况以及基因表达的水平及所占比例,直至显微镜下观察荧光细胞比例为90%以上。
(2)G418筛选:由于每种细胞对G418的敏感性不同,一般变动在100ug/ml~1000ug/ml范围。
通过预实验确定了最佳筛选浓度后,就可以做病毒感染了。
a.感染:感染培养48小时或者更长,到细胞增长接近汇合时按1:4密度传代,继续培养,待细胞密度增至50%~70%汇合时;
b.加G418:去掉培养液,PBS洗一次,加入按最佳筛选浓度配制好的G418筛选培养基。
c.换液:根据培养基的颜色和细胞生长情况,每3~5天更换一次筛选培养基。当有大量细胞死亡时,可以把G418浓度减半维持筛选。
d.观察:每天观察细胞的生长情况及荧光的所占比例,直至显微镜下观察荧光细胞比例为90%以上。
(3)潮霉素筛选:潮霉素用来筛选稳转株的工作浓度需要根据细胞类型,培养基,生长条件和细胞代谢率而变化。推荐使用浓
度为50-1000μg/ml。一般而言,哺乳动物细胞50-500μg/ml,细菌/植物细胞20-200μg/ml,真菌300-1000μg/ml。对于第一次使用的实验体系建议通过建立杀灭曲线即剂量反应性曲线,来确定最佳筛选浓度。
并非所有的病毒载体都适合用来进行稳定株筛选,首先需要挑选整合效率高,整合位点稳定的病毒载体。至今为止,逆转录病毒载体是最有效的可以介导基因整合的病毒载体。其次,依据具体实验要求,挑选不同整合位点倾向性的逆转录病毒载体。
倾向于整合于转录起始位点附近的,容易造成下游基因的激活; 而整合于转录活跃基因内的,容易导致整合区基因的插入失活。

在线咨询

电话咨询
18225607483
客服服务热线

扫一扫

微信扫一扫

